
Thẩm Định Nồi Hấp Tiệt Trùng – Quy Trình, Phương Pháp Thẩm Định Nồi Hấp Ngành Dược Phẩm
Thẩm định nồi hấp tiệt trùng là quy trình quan trọng nhằm đánh giá độ ổn định của nồi hấp, đảm bảo tiêu diệt được vi sinh vật trong quá trình vận hành. Trong bài viết dưới đây, Thiết bị Hiệp Phát sẽ giúp bạn hiểu rõ hơn về quy trình cũng như hệ thống, phương pháp thẩm định nồi hấp đạt chuẩn chất lượng.
Thẩm định nồi hấp tiệt trùng là gì?
Thẩm định là gì?
Theo FDA 21 CFR Part 11, Thẩm định là việc thiết lập bằng chứng tài liệu, tạo sự đảm bảo rằng một quy trình cụ thể sẽ liên tục tạo ra sản phẩm đáp ứng các đặc điểm kỹ thuật và chất lượng đã được định trước.
Thẩm định nồi hấp là gì?
Thẩm định nồi hấp tiệt trùng là quá trình chứng minh rằng hệ thống tiệt trùng bằng hơi nước hoạt động ổn định, có khả năng tiêu diệt vi sinh vật trong các điều kiện xác định, đảm bảo rằng sản phẩm hoặc thiết bị sau tiệt trùng đạt mức độ vô khuẩn yêu cầu.
Thẩm định nồi hấp bao gồm nhiều bước: IQ, OQ, PQ, để đảm bảo nồi hấp vận hành đúng thiết kế và quá trình vận hành luôn đạt hiệu quả.

Nguyên tắc FDA trong thẩm định nồi hấp tiệt trùng
- Xây dựng quy trình đảm bảo tiệt trùng
- Xác nhận hiệu quả của thiết bị và điều kiện vận hành. Chứng minh khả năng tái lập đạt tiệt trùng
- Chứng minh chu trình hấp đạt được mức độ tiệt trùng yêu cầu SA: (Sterility Assurance Level) ≤ 10⁻⁶
Quy trình thẩm định nồi hấp tiệt trùng
Gồm 4 bước chính:
- Đánh giá thiết bị (Equipment Qualification)
- Thẩm định chu trình tiệt trùng (Sterilization Cycle Validation)
- Lập bản đồ tải và nghiên cứu xâm nhập nhiệt (Load Mapping & Heat Penetration Studies)
- Kiểm tra chất lượng và độ ổn định của sản phẩm (Product Quality & Stability Testing)
Đánh giá thiết bị (Equipment Qualification)
Thẩm định nồi hấp theo hồ sơ IQ (Installation Qualification): Kiểm tra lắp đặt, kết nối
Xác nhận nồi hấp được lắp đặt đúng theo yêu cầu kỹ thuật của nhà sản xuất và tiêu chuẩn. Bao gồm kiểm tra vị trí lắp, kết nối nguồn điện, nguồn nước/ nguồn hơi; kiểm tra tình trạng gioăng, van an toàn; đảm bảo các cảm biến nhiệt độ, áp suất đã được hiệu chuẩn; tài liệu kỹ thuật (hướng dẫn vận hành, sơ đồ điện/nước chúng từ xuất xưởng. v.v.) đầy đủ.
Bộ chỉ thị nhiệt độ hoạt động ổn định, đồng hồ áp suất không có hiện tượng thay đổi đột ngột, biến động.
Đối với nhiệt kế chỉ thị hiện số, các số hiển thị phải rõ nét, không bị mờ hoặc mất nét. Vạch chia đồng hồ áp kế còn đầy đủ, không bị nhòe hoặc mất chữ số, kim chỉ thị không bị ma sát hoặc kẹt kim.
Nắp nồi hấp phải đảm bảo độ kín và các bộ phận khác của thiết bị hoạt động bình thường.
Thẩm định nồi hấp theo hồ sơ OQ: Kiểm tra chức năng và cảm biến
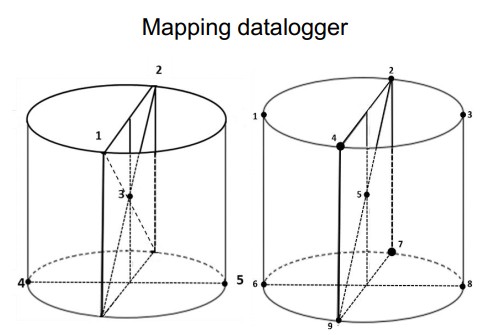
Kiểm tra các chức năng và hoạt động của nồi hấp đáp ứng thông số thiết kế trong điều kiện không tải và có tải mô phỏng.
Thực hiện chạy thử các chu trình tiệt trùng trong điều kiện không tải (empty chamber) để đo khả năng đạt nhiệt độ ở các điểm khác nhau trong buồng (Empty Chamber Temperature Distribution): đặt nhiều đầu dò nhiệt độ tại các góc, gần đầu dò điều khiển và các vị trí đại diện trong buồng.
Kết quả OQ xác nhận phân bố nhiệt độ đồng đều trong buồng ở thời gian giữ nhiệt, đảm bảo không có chênh lệch vượt quá giới hạn cho phép giữa các điểm. Các chức năng an toàn (khóa cửa, van xả áp, báo nhiệt độ/quá áp) cũng được kiểm tra hoạt động.
Trong OQ thường không dùng chỉ thị sinh học cho thử buồng rỗng, vì tập trung vào đo lường vật lý nhiệt độ áp suất.
- Nhiệt độ môi trường xung quanh thiết bị:18 °C – 27 °C.
- Độ ẩm môi trường xung quanh thiết bị : RHs75 %RH.
Cài đặt đầu dò ghi nhiệt: 30 giây thu dữ liệu 1 lần;
Cứ 5 phút ghi lại số hiển thị trên thiết bị nồi hấp;
Sau khi thực hiện xong việc hiệu chuẩn, lấy các đầu dò ra và lấy dữ liệu từ đầu dò
Đối với thiết bị có thể tích làm việc V <0,1 m3: Bố trí 3 hoặc 5 đầu dò nhiệt.
Đối với thiết bị có thể tích làm việc V 20,1 m3: Bố trí 7,9 hoặc 11 đầu dò nhiệt.

Các thông số đánh giá
* Độ đúng: Chênh lệch nhiệt độ thực tế và nhiệt độ cài đặt ± 1,0 °C.
* Độ đồng đều tổng: ± (1,0 – 2,0) °C
* Độ ổn định: ≤ 1,0 °C.
> Xác nhận rằng nhiệt độ được phân bố đồng đều trong toàn bộ buồng hấp khi không có tải,
> Giúp phát hiện các điểm “cold spot”
Thẩm định chu trình tiệt trùng (Sterilization Cycle Validation)
Thẩm định nồi hấp theo hồ sơ PQ: Kiểm tra thực tế trên tải
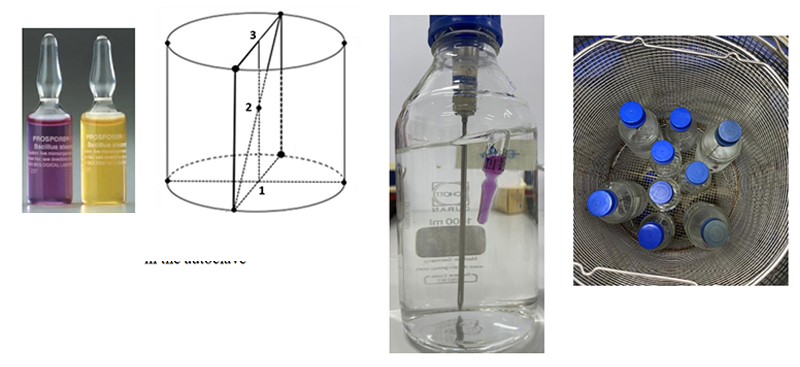
Mục tiêu PQ
Xác minh rằng nồi hấp tiệt trùng có khả năng tiêu diệt hoàn toàn vi sinh vật trên toàn bộ sản phẩm, tại mọi vị trí trong buồng hấp, một cách ổn định, lặp lại được và được kiểm soát.
Thực hiện PQ
PQ bao gồm thử tiệt trùng trên các loại tải đại diện cho sử dụng thực tế (ví dụ: dụng cụ rỗng môi liên tiếp và đánh giá kết quả của từng chu kỳ. trường lỏng, vật liệu đóng gói, chất thải sinh học). Với mỗi loại tải, tiến hành tối thiểu 3 chu kỳ tiệt trùng.
Trong quá trình PQ bố trí các đầu đo nhiệt độ và chỉ thị sinh học (BI) tại những vị trí được coi là “điểm lạnh” – nơi khó tiệt trùng nhất trong tải (xác định từ giai đoạn OQ/mapping). Sau mỗi chu kỳ, thu thập Kiểm tra biểu đồ nhiệt độ, tính toán hoặc ghi nhận giá trị Fo đạt được;
Dữ liệu
Ủ các BI để kiểm tra vi khuẩn có sống sót không. Đặc biệt, toàn bộ các chỉ thị sinh học phải bị tiêu diệt hoàn toàn (không có mẫu BI nào phát triển sau ủ).
Nếu bất kỳ tiêu chí nào không đạt, phải tiến hành điều tra nguyên nhân và thực hiện hành động khắc phục, sau đó lặp lại thử nghiệm PQ cho đến khi đạt.
Kết quả PQ
Khi 23 chu kỳ liên tục đạt yêu cầu, có thể kết luận nồi hấp vận hành đạt hiệu năng tiệt trùng đối với loại tải đó. Tài liệu PQ bao gồm báo cáo chi tiết dữ liệu nhiệt độ/áp suất, kết quả BI và xác nhận rằng tiêu chí vô trùng đã thỏa mãn cho mỗi chu kỳ.
PQ hoàn tất đánh dấu quá trình thẩm định nồi hấp, cho phép đưa thiết bị vào sử dụng chính thức.
Đánh giá hiệu năng nồi hấp
Đánh giá hiệu năng nồi hấp là một phần của thẩm định, giúp hoàn thiện hồ sơ PQ, nhằm khẳng định nồi hấp khi vận hành theo quy trình chuẩn, có khả năng tạo ra kết quả tiệt trùng đạt tiêu chí định trước một cách ổn định.
Hiệu quả chu trình tiệt trùng bằng hơi nước thường được đánh giá bằng giá trị F0, được định nghĩa là thời gian tiếp xúc tương đương tại nhiệt độ 121°C.
Lập bản đồ tải và nghiên cứu xâm nhập nhiệt (Load Mapping & Heat Penetration Studies)
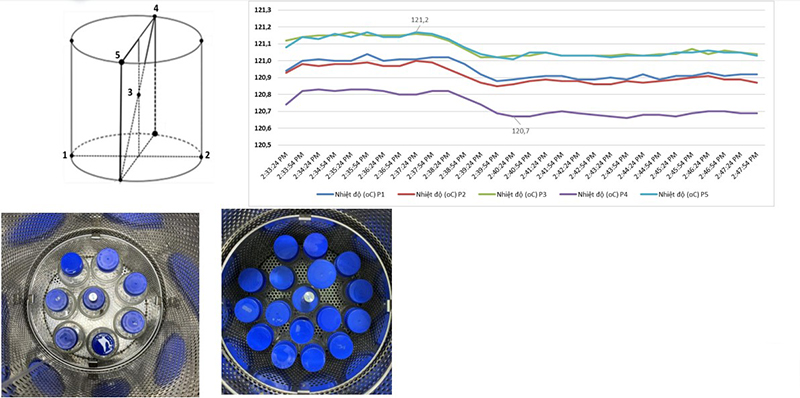
Lập bản đồ tải và nghiên cứu xâm nhập nhiệt: Đánh giá khả năng phân bố nhiệt độ và độ xâm nhập hơi vào từng vị trí trong tải (bao gồm cả vị trí khó tiếp cận).
Mục tiêu: là đảm bảo tất cả các sản phẩm trong tải đều tiếp nhận đủ điều kiện tiệt trùng
Yêu cầu Load Mapping : Tải lớn nhất và nhỏ nhất được thử nghiệm để xác định vị trí nóng/ lạnh. Các vật hấp phải được đặt đúng cấu hình thực tế vận hành.
Yêu cầu Heat Penetration Studies: Đặt BI và đầu dò trong tải tại “cold spot” để đo.
Kiểm tra chất lượng và độ ổn định của nồi hấp (Product Quality & Stability Testing)
Tần suất Kiểm tra, hiệu chuẩn nồi hấp cần được đảm bảo tuân thủ theo khuyến cáo của nhà sản xuất hoặc Trung tâm hiệu chuẩn – kiểm định.
– Kiểm định: khoảng 2 – 3 năm/ 1 lần (đối với nồi hấp mới), 1 năm/1 lần đối với nồi hấp đã sử dụng trên 5 năm (tùy theo tình trạng nồi hấp)
– Hiệu chuẩn: 1 năm/ 1 lần
* Lưu ý: Với các ứng dụng, thử nghiệm hoặc các cấu hình thiết bị đặc thù, có thể Giảm thời gian giữa các lần hiệu chuẩn và kiểm tra nồi hấp
Hệ thống thẩm định nồi hấp tiệt trùng
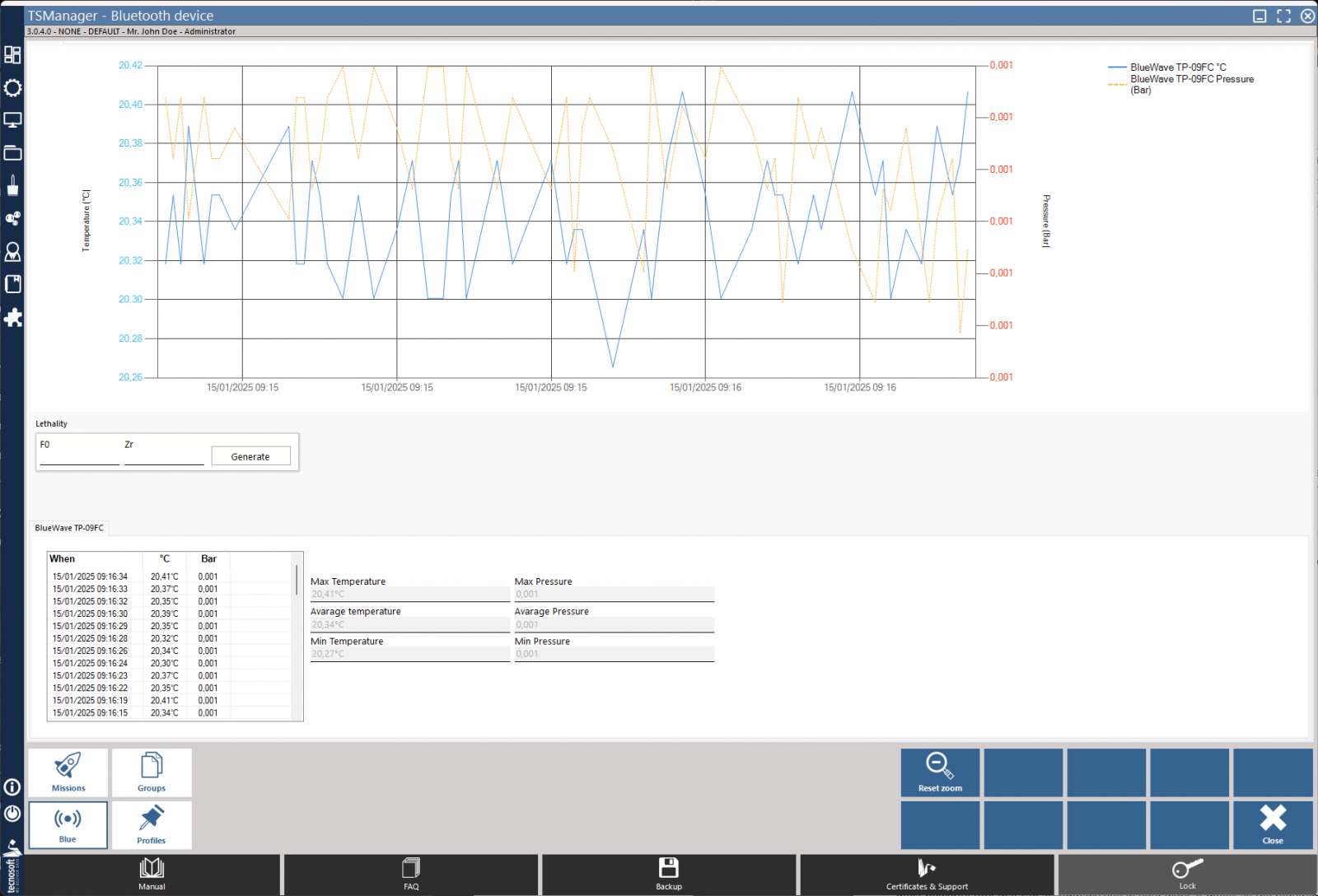
TS Manager 3 là Phần mềm thẩm định (Validation), chứng nhận (Certification) và đánh giá đủ điều kiện (Qualification), lập bản đồ (Mapping) và sử dụng hàng ngày hỗ trợ tất cả các dòng thiết bị ghi nhiệt độ BlueWave, cũng như Datalogger nhiệt độ bằng thép không gỉ Tecnosoft khác để giám sát các quy trình thời gian thực.


TS Manager 3 đáp ứng tất cả các yêu cầu của quy định FDA 21 CFR Phần 11, GAMP5, Phụ lục 11 (chỉ có phiên bản Basic và Pro) và cung cấp nhiều chức năng và tùy chọn để phân tích và báo cáo dữ liệu của bạn. Đây là công cụ mạnh mẽ và là tài nguyên “phải có” cho thẩm định tất cả các thiết bị nồi hấp, tủ ấm, thiết bị thanh trùng, máy rửa khử khuẩn và các thiết bị chăm sóc sức khoẻ khác.
Hy vọng rằng bài viết trên đây đã giúp quý khách hàng hiểu rõ hơn về quy trình thẩm định nồi hấp tiệt trùng trong ngành dược phẩm. Bên cạnh đó, Công ty TNHH Thiết bị Hiệp Phát hiện cũng đang là nhà phân phối ủy quyền hãng ALP – Nhật Bản và hãng Tecnosoft – Ý, chuyên phân phối các dòng nồi hấp tiệt trùng, cùng Datalogger, hệ thống thẩm định nồi hấp tiệt trùng chuyên dụng trong ngành dược phẩm. Hiệp Phát hiện cũng cung cấp dịch vụ xây dựng hồ sơ IQ, OQ, PQ cho thẩm định nồi hấp tiệt trùng. Nếu quý khách hàng có nhu cầu tìm mua các dòng sản phẩm, hoặc có yêu cầu về dịch vụ thẩm định nồi hấp tại Hiệp Phát, đừng ngần ngại liên hệ ngay Sđt: 0919.537.653 – Mr. Tú hoặc Email: sales5@thietbihiepphat.com để được hỗ trợ kịp thời.

Để lại thắc mắc, chúng tôi sẽ giải đáp ngay cho bạn



 VN
VN














